Termodinamiğin birinci yasası ısı geçişiyle iş arasında, enerji olarak ayırım yapmaz. Birinci yasa açısından ısı geçişi ve iş eşdeğerdedir. Isı geçişiyle iş arasındaki ayrım ikinci yasa tarafından ortaya çıkarılmaktadır. Başka bir deyişle, entropi geçişinin olmadığı enerji etkileşimi ise iştir. Bir sistemle çevresi arasında olan iş etkileşimi sırasında entropi alış verişi yoktur. Böylece, sistemle çevresi arasındaki iş etkileşimi sırasında sadece enerji alış verişi olur, oysa ısı geçişi sırasında hem enerji hem entropi geçişi söz konusudur.

Sistem sınırlarından iş geçişi sırasında entropi geçişi olmaz. Ancak, sistem içinde enerji daha az kullanılabilir biçimlere dönüşürken entropi üretimi olur.
Entropi kavramını daha iyi anlayabilmek için özel bir kap içinde sıvı halde bir miktar soğutucu akışkan ele alalım. Bu soğutucun akışkan ∆Q kadar bir ısının tesiri altında kaynamaya terk edildiğinde ve belirli bir sıcaklıkta kaynamaya başladığını düşünelim. Bu durumda entropi diyagramda görüleceği gibi entropilerin farkı (S2−S1) kadar değişmiştir.
S2−S1=ΔQ / T
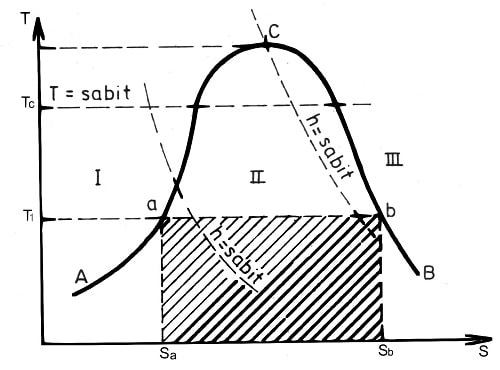
Sıcaklık entropi diyagramı
Diyagramı şekilde verilen 1 No’lu bölge sıvı, 2 No’lu bölge sıvı+buhar (yaş buhar), 3 No’lu bölge kızgın buhar bölgesidir. A−C eğrisi, sıvı bölgesi ile yaş buhar bölgesini ayıran bir sınır eğrisi olup, alt sınır eğrisi olarak adlandırılır. C−B eğrisi ise yaş buhar bölgesi ile kızgın buhar bölgesini ayran bir sınır eğrisi olup, üst sınır eğrisi olarak adlandırılır. C noktası kritik noktayı göstermektedir.
Herhangi bir soğutucu akışkanı T1 sıcaklığında kaynadığını düşünelim. Diyagram a noktası soğutucu akışkanın sıvı olduğu nokta, b noktası ise soğutucu akışkanın doymuş buhar halinde olduğu noktadır. Böyle bir buharlaşma için gerekli ısı miktarı
q=T1(S2-S1)
olarak hesaplanır. Bu ısı miktarı T-S diyagramında bir alan olarak görülür.
Örnek Problem 5.3
İlk şekilde gösterilen sürtünmesiz piston silindir düzeneğinde başlangıçta 100 °C sıcaklığında doymuş sıvı-buhar karışımı su bulunmaktadır. Daha sonra 25 °C sıcaklıktaki çevre havaya sabit basınçta bir hal değişimiyle, 600 kJ ısı geçişi olmaktadır. Hal değişimi sırasında silindir içinde bulunan su buharının bir bölümü yoğuşmaktadır.
a) Suyun entropi değişimini hesaplayınız?
b) Hal değişimi sırasında çevre havanın entropi değişimini bulunuz?
Çözüm
Basınç sabit kaldığı için, sıcaklığıda 100°C değerinde kalacaktır.
ΔSu=Qsu / Tsu = -600 kj / (100+273) K = -1.6.1 kj/K
Dikkat edilirse suyun sıcaklığında bir değişiklik olmayıp çevreye verilen ısı, su buharının bir bölümünün daha yoğuşmasına harcanarak entropisinin azalmasına neden olmuştur.
Düşük sıcaklıkta ısıl enerji deposu çevre havanın entropi değişimide benzer biçimde hesaplanır. Fakat bu kez ısı geçişi artı değerdedir .Çünkü sistem tarafından verilen ısı çevre hava tarafından alınmaktadır.
QÇevre= -QSİistem= 600 kJ
ΔSçevre=Qçevre / Tçevre = 600 kj / (25+273) K =2,01 kj/K
Entropi moleküler düzensizlik veya moleküler rastgelelik olarak görülebilir. Bir sistem daha düzensiz bir hal aldıkça moleküllerin konumları belirsizleşecek ve entropi artacaktır.
Bir maddenin moleküler düzensizliğinin ölçüsü olan entropi madde erirken veya buharlaşırken artar.



